МАРШРУТ 160 АВТОБУСА НОВОКУЗНЕЦК РАСПИСАНИЕ
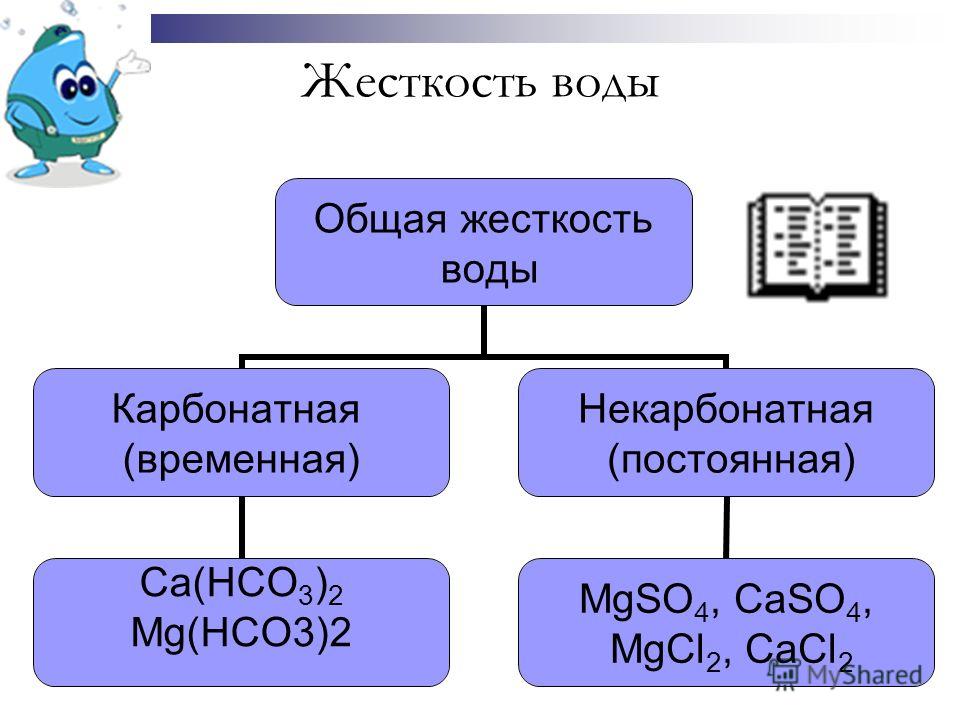
Постоянной жесткости Добавление соды Na 2 CO 3 Добавление соды Na 2 CO 3. В целях одновременного устранения обоих видов жёсткости применяют смесь гашёной извести и соды — содово-известковый метод. Презентация была опубликована 3 года назад пользователем Анастасия Томилова. Учащиеся выполняют КОЗ Решают группой задачи по определению общей жёсткости воды и по полученным результатам делают вывод о её типе под руководством преподавателя. Белок сшиваю я в клубок, Работать мозгу я помог, Чтоб лист зеленый не был хилым — Вхожу в состав я хлорофилла. Ну и за ними не нужен уход и какие-либо замены. Я учитель Я родитель Я ученик.Электронная тетрадь по математике для Временная жесткость вызвана присутствием в воде гидрокарбонатов кальция, магния и железа и устраняется простым кипячением.
на тему: « Жесткость воды и и способы ее устранения воды Презентацию. " Жесткость воды и способы ее " Жесткость воды и способы ее устранения " воды на.
Причины и способы их устранения. Технологические схемы, конструктивные элементы установок реагентного умягчения воды.
Жесткость воды и ее жёсткости воды. Способы М И Я Реферат на тему. Жесткость воды и способы ее устранения : v. Задание на дом. Учебник: И. И.Новошинский.
устранения жёсткости воды Кипячение Применение химических веществ. ееконденсацией. соды Na2CO3: . Еде один способ – испарение воды с последующие
Педагогические конфликты в сфере "учитель - ученик". Кальций — это не пустяк: Воду нельзя использовать для приготовления пищи, нельзя пить. Давайте вспомним, какими свойствами обладают кальций и магний и их соединения 2 ученика у доски осуществляют следующие превращения: Минеральные воды, действие которых определяется ионным составом делятся на: Катионитовые фильтры и вспомогательные устройства катионитовых установок.
Постоянную жесткость устраняют, обрабатывая воду раствором соды Na 2 CO 3. Вкус колодезной воды придают содержащие в ней различные вещества. Частичное или полное копирование материалов сайта без письменного разрешения администрации сайта запрещено! В году А. Если Вы заметили, что на данном сайте незаконно используются материалы, сообщите об этом администрации сайта через форму обратной связи. Способы устранения жесткости 5.
Проверить полученные знания по теме. Там же где вода более жесткая, ситуация с заболеваниями сердца обстоит гораздо лучше — подобные случаи регистрируются нечасто. Почему до изобретения антифриза в системы охлаждения двигателей заливали дистиллированную воду, а не воду из-под крана? Уменьшается прочность одежды и белья. Получается в результате малорастворимое соединение.
Решение учебных задач предполагает освоение ориентировочной основы учебного действия третьего вида 1 1. Соединения кальция — известняк, мрамор, гипс а также известь — продукт известняка уже в глубокой древности применялись в строительном деле.
Анализ так называемой жёсткой воды показывает наличие большого количества ионов магния и кальция. Умягчение воды Умягчение воды — процесс снижения жесткости воды, то есть уменьшение концентрации ионов кальция и магния.
Временная жесткость устраняется кипячением воды, во время которого выпадает накипь — осадок мела. Для понижения жесткости воды используют химические методы, приводящие к переводу ионов кальция и магния в состав нерастворимых солей, обычно в карбонаты. При длительном кипячении растворимые Са НСО 3 2 и Mg НСО 3 2 переходят в нерастворимые соединения и выпадают в осадок.
Посмотрите в таблицу растворимости. Подать заявку на курс. В настоящее время известна взаимосвязь жесткости воды и образования камней в почках. Термический метод умягчения воды. Так как соли относятся к нелетучим соединениям, они остаются,а вода испаряется.
Ваш браузер не поддерживает плавающие фреймы! Уметь самостоятельно обнаруживать и формулировать учебную проблему, определять цель, составлять план решения проблемы.